Reacția interacțiunii dintre CaCl2, H2SO4
Unul dintre obstacolele din primii pașistudiul regularităților chimice și al fundamentelor este scrierea reacțiilor chimice. Prin urmare, întrebările despre interacțiunea dintre CaCl2, H2SO4 nu sunt nici periodic, ci sistematic. Să analizăm principalele momente de "problemă".
Înregistrarea ecuației moleculare
Interacțiunea dintre clorura de calciu (sare) și acidul sulfuric se desfășoară în conformitate cu mecanismul de schimb.
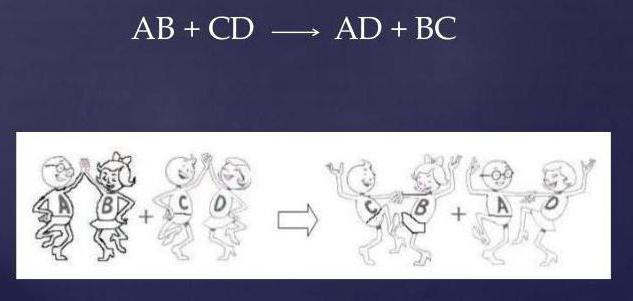
- doi compuși la intrare (materii prime);
- două conexiuni la ieșire (produse);
- absența completă a substanțelor simple.
Prin schimbarea grupurilor de reacție între ele, reactivii sunt modificați și ecuația ia forma:
CaCI2 + H2S04 = CaS04 + 2HCI.
După cum se poate observa, două substanțe complexe, schimbând ionii, formează compuși complet diferiți: o nouă sare (CaSO4) și acid clorhidric (HCl).
Posibilitatea de a curge până la capăt
Răspunde la această întrebare poate fi pur și simplu scriind la CaCl2, ecuația reacției în formă moleculară H2SO4. De la fel de produse și totul va depinde. Până la sfârșitul procesului se află în cazul educației:
- o substanță puțin solubilă (precipitat);
- un compus volatil (gaz);
- reactiv slab dizolvat (apă, electrolit slab).
Luând în considerare cazul CaCl2, H2SO4 se printre produșii de reacție de sulfat de calciu - compus slab solubil precipită conform tabelului.

În consecință, procesul de schimb va merge până la capăt.
Forma ionică redusă a înregistrării între CaCl2, H2SO4
Pictând toți compușii solubili pe ioni și reducând grupurile de reacție repetitive, obținem cele două ecuații cerute:
- forma ionică totală a înregistrării dintre CaCl2, H2SO4
CA2+ + 2cl- + 2h+ + așa42- = caso4 + 2h+ + 2cl-
- forma redusă a ecuației
CA2+ + așa42- = caso4.
Trebuie să ne amintim că ionii sunt doar vopsitesăruri solubile, acizi, baze (acest lucru este ușor determinat de tabele speciale). Electroliții slabi, cum ar fi cărbunele sau acidul acetic, sunt întotdeauna scrise în formă moleculară.
Acum știi cum are loc interacțiunea dintre clorura de calciu (sare) și acidul sulfuric.

