Grade de oxidare a arsenului: proprietăți chimice ale arsenului
Înainte de a lua în considerare starea de oxidarearsenic, ne vom dezvălui poziția în tabelul periodic și în trăsăturile structurii. În plus, să menționăm proprietățile fizice și chimice de bază ale acestui element chimic.

Poziția în PS
Principalele stări de oxidare ale arsenicului, chimiceproprietăți, aplicație - toate acestea pot fi învățate prin analizarea locului elementului în sistemul periodic al lui Mendeleev. Arsenic este situat în al cincilea grup, principalul subgrup, fiind membru al familiei de azot. Are o masă atomică relativă de 74,9216. Principalele grade de oxidare a arsenului sunt legate exact de grupul în care se află în SS. Acest element are 33 de numere de serie. Numărul de niveluri de energie corespunde numărului perioadei în care se află elementul, este egal cu patru.
Luați în considerare aranjamentul de electroni pe fiecarecoajă atomică. La primul nivel de energie există doar doi electroni cuplați, a doua coajă este ocupată de opt particule: 2s și 6p. La al treilea nivel, în afară de ele, există zece d-electroni, adică doar 18 particule. Nivelul energiei externe este un electron cu 2 s-uri, precum și trei electroni p nepărpați. Este numărul de electroni de valență care determină gradele posibile de oxidare a arsenului.

Pagini ale istoriei
Arsenicul este atribuit celor cinci "alchimice"elemente cunoscute din Evul Mediu. Un punct interesant este faptul că patru dintre ele se află în al cincilea grup PS. În acele zile nimeni nu știa cum să determine gradul de oxidare a arsenului, dar compușii săi au fost utilizați cu succes pentru a face medicamente, pentru a crea vopsele.
După înlocuirea Erei de Piatră de epoca bronzului, oameniia învățat cum să facă acest aliaj cu caracteristici speciale. Se pare că a conținut până la 7% din arsen și doar 3% din staniu. Oamenii de știință cred că la prima topire a bronzului în loc de malachit, care este verde, a luat în mod eronat sulfurile verzi ale mineralelor de cupru și arsenic.
Performanța uimitoare a aliajului rezultat a făcut-o populară printre maeștrii antice. Ei au căutat în mod specific în natură mineralele care conțin substanța.
Grade de oxidare a arsenului în compuși ai acestoratip pozitiv, corespunde valenței sale mai mari. Pentru a identifica sulfurile care conțin arsenic, mineralul este încălzit. Apariția unui miros specific de usturoi este o confirmare a prezenței arsenului în compus. Treptat de la topirea bronzului de arsen a refuzat. Printre motivele încetării producției, oamenii de știință numesc otrăvirea constantă a maeștrilor în timpul muncii.

Minerale naturale
Sub formă de minerale, substanța pe care o analizămcunoscută din cele mai vechi timpuri. De exemplu, starea de oxidare a arsenului 3 apare într-un compus cunoscut în China antică drept "praf de mine". Aristotel a descris sandarakul mineral, care este un sulfid de arsen. Tradus din limba latină, numele său pare a fi "vopsea de aur". Folosit în acele vremuri îndepărtate ca o vopsea galbenă.
În secolul al unsprezecelea, alchimiștiidiferite tipuri de substanță. Gradul de oxidare a arsenului în compușii reprezentați de aceste specii corespunde numărului de grup. Arsenic alb a numit-o oxid hexavalent, galben se numește sulfură, și roșu - As4S4 (tetrasulfid tetrashyyyaka).
Varianta albă a fost obținută prin sublimarea impurităților înprocesul de ardere a minereurilor de cupru, care include arsenic. Ca condensare din starea gazoasă, oxidul de arsenic precipită ca un depozit alb. Acesta a fost folosit din timpuri străvechi ca mijloc de distrugere a dăunătorilor.
În secolul al treisprezecelea, Albert cel Marese obține o substanță metalică. El a încălzit arsenul galben cu săpun. Substanța obținută ca urmare a interacțiunii nu a confirmat "conexiunea mistică" a celor șapte metale cu planetele. Poate, tocmai din cauza contradicției revelate de alchimiștii străvechi, arsenicul a fost considerat un element "nelegitim". A fost în acele zile a fost dezvăluit abilitatea de a conferi cupru alb, astfel încât a devenit cunoscut ca un mijloc de „albire Venus“.
Ca substanță individuală, acest lucruelementul chimic a fost identificat numai la mijlocul secolului al XVII-lea. Farmacistul german Johann Schröder a reușit să-l izoleze prin efectuarea unei reduceri chimice a oxizilor de cărbune. După ceva timp, Nichola Lemery a reușit să extragă metalul încălzind potasiul, săpunul, oxidul de arsen. În secolul al XVIII-lea, acest metal era cunoscut ca un "semimetal" neobișnuit.
La sfârșitul secolului al XVIII-lea chimistul suedez K.V. Scheele a obținut acidul arsenic, în care apare cel mai înalt grad de oxidare a arsenicului: +5. În secolul al XIX-lea, substanțele organice care conțin arsen au fost identificate.

Fiind în natură
Grad mai mare și mai mic de oxidare a arsenuluimanifestată în compușii săi naturali. În crustă, concentrația procentuală a acestui element nu depășește 5 grame pe tonă. În multe minerale, este conținut simultan cu nichel, cobalt, cupru, fier.
În prezent sunt cunoscute aproximativ două sutediverse minerale naturale, care includ elementul chimic în cauză. Având în vedere că ele prezintă cel mai înalt și cel mai mic grad de oxidare a arsenului, acestea au aplicații diferite. De exemplu, în combinație cu antimoniu, arsenul prezintă o stare de oxidare negativă. Având în vedere faptul că acest metal are o electronegativitate scăzută, cel mai mic grad de oxidare a arsenicului este -3. Acest indicator este tipic pentru arsenide, precum și pentru mineralul Alelemontit.
Majoritatea compușilor cu metale de arsen, ținând cont de specificitatea compoziției, sunt compuși intermetalici care diferă în compoziția variabilă a acestui element chimic.
Caracteristica arsenidelor
Pentru arsenide, conținutul mai multormetale cu o structură similară de laturi cristaline. Aceste minerale sunt caracterizate de luciu metalic, sunt opace, au o ușoară duritate.
Ca exemple de arsenide naturale, se pot lua în considerare următorii compuși:
- lellingite, similar cu pirita;
- nickel, numit pirite de nichel roșu;
- langisit;
- Oregon;
- aperilita.
Aceasta, desigur, nu este o listă completă.minerale similare - în prezent există aproximativ douăzeci și cinci de astfel de compuși. Printre cele mai frecvente în natură se numără arsenopirită, numită pirită de arsen. Este un produs obținut prin înlocuirea atomilor de sulf în pirită cu arsen. Compușii de acest fel, în care nu se manifestă cel mai înalt grad de oxidare a arsenului, se numesc sulfosalți.
Omologii lor sunt luciul de cobalt,Gersdorfit, enargit și, de asemenea, prust. Acesta din urma este un minereu de argint important, situat in stratul superior al venelor pretioase. Compoziția sulfosalților poate include metale nobile din grupul de platină. Dintre acestea, interesul este irarsitul, precum și Orsit. În compoziția lor există metale rare utilizate ca catalizatori excelenți în sintezele organice și anorganice.
Gradul maxim de oxidare a arsenuluimanifestată în sulfurile sale naturale. De exemplu, în dimorfitul galben-portocaliu, care este sulfura de arsen (5). În anii treizeci ai secolului trecut, depozitele naturale ale orpimentului, inclusiv sulfura de arsen trivalent, au fost descoperite în sudul lanțului Verkhoyansk. Dimensiunile cristalelor detectate au ajuns la 60 de centimetri în lungime, iar greutatea a fost estimată la 30 de kilograme.

Caracteristica arsenatului
Posibile grade de oxidare a arsenicului pot fiia în considerare exemplul de săruri. Astfel, compușii acidului arsenic, denumiți arsenați, demonstrează rata maximă pentru acest metal: +5. Ca un exemplu de astfel de compuși, oferim eritrină, având o culoare roz roz. Această sare se numește culoare cobalt, are formula Co3 (AsO4) 2 * 8H2O. Este, de asemenea, posibil să se observe gazparita unei culori roșu-maroniu sub formă de (Ce, La, Nd) ArO4.
Langbanovskys a descoperit în centrul Suedieifier-mangan, unde au fost găsite și caracterizate aproximativ cincizeci de arsenați diferiți. Acești compuși s-au format prin interacțiunea acidului arsenic cu hidroxidul de mangan (2) la temperaturi scăzute.
Care sunt stările de oxidare din arsenați?Arsen? Caracteristica acestor săruri confirmă prezența sulfului în ele. În ciuda lipsei de aplicare industrială, aspectul lor estetic le permite să fie folosite pentru a crea colecții mineralogice.
O poveste interesantă este Kupfernickel, carecorespunde cu nichelul mineral. Minerii germani medievali numesc Nickel spiritul răului muntean, iar "cuprul fals" era numit "cupfernickel". Maeștrii au arătat asemănarea externă a cristalelor de cupru-roșii ale acestui mineral cu minereuri de cupru. Folosit în sticlă pentru a da produsului rezultat o nuanță verde. Numai la mijlocul secolului al XVIII-lea mineralogistul Axel Kronstedt a reușit să extragă nichel din acest mineral.
Caracteristicile plasării în natură
Arsenicul se caracterizează prin inerție ridicată,prin urmare, poate fi găsit în starea sa nativă. Un metal similar din compoziție are de la două la șaisprezece la sută din impurități, în principal vor fi argint, fier, cobalt, nichel. În țara noastră, geologii au descoperit arsenic nativ în regiunea Amur, Transbaikalia.
Acesta poate fi găsit în roci, în minerale și în plante, deci este adesea numit elementul omniprezent de drept.
Care este gradul maxim și minimoxidarea arsenicului? Valoarea cea mai mare corespunde numărului grupului în care se află elementul și este de +5. Acest lucru este tipic pentru compușii în care prezintă proprietăți de reducere. În detaliu, vom lua în considerare conexiunile acestui metal unic mai târziu.
Arsenicul este distribuit extrem de inegal în întreaga lume. Motivul este formarea litosferei, precum și în procesele de desorbție și sorbție care apar în rocile sedimentare și solurile.
Datorită solubilității excelente a acestui metal în apă, acesta migrează ușor. De exemplu, într-un climat umed, este spălat din sol, urmată de mișcarea împreună cu apele subterane și râuri.

Acțiune fiziologică
În cantități substanțiale, arsenul este conținut înapele minerale. Există anumite standarde pentru conținutul acestui metal. Dacă valorile admise sunt depășite, există o amenințare serioasă de rău organismului uman. În timpul cercetării chimice, sa constatat că arsenicul poate fi conținut în diferite forme în apă naturală. Care ar trebui să fie gradul de oxidare a arsenicului? Proprietățile compușilor găsiți în apă confirmă prezența unui metal sub formă de soluție de acid arsenic.
Arsenicul într-o formă vie conține aproximativ 6 mg pe 1kg. O porțiune din alge marine poate acumula în sine substanța menționată într-o asemenea măsură încât poate fi periculoasă pentru corpul uman. Unele dintre speciile lor găsite în țările asiatice pot să se înmulțească într-o soluție de acid curat. Acestea sunt folosite ca un mijloc de a trata șobolanii. În țesutul cerebral al unei persoane, precum și în mușchii săi, există o cantitate suficientă din acest metal. În plus, este prezentă în plăcile unghiilor, se acumulează în păr.
Caracteristici fizice
Deși arată arsenulmetal, are semne nemetalice. De exemplu, nu este capabil să formeze săruri cu acid sulfuric, acționând ca un element care formează acid. Arsenicul poate exista în diferite modificări alotropice, asemănătoare cu fosforul. Cel mai stabil este arsenul gri, care atunci când este încălzit se sublimează în mod similar cu iodul.
Pentru conductivitatea electrică, această modificareinferior la cupru, dar depășește mercurul. Atunci când se răcește vaporii de arsen, puteți obține o substanță moale transparentă, de culoare galbenă, similară cu cea a fosforului galben. În procesul de încălzire, se transformă într-o altă modificare alotropică a elementului chimic.
Atunci când se precipită vapori de arsen pe sticlă, se poate observa aspectul unui film oglindat.
Compuși de arsen
Gradul de oxidare a arsenicului în oxidul superioreste +5, adică corespunde valenței sale mai mari. Dar, în timpul sublimării vaporilor acestui metal în aer umed, se formează un film negru al anhidridei sale de arsenic As2O.3. În această formă este în principiu oxidul acestui element. Acest oxid prezintă proprietăți chimice amfoterice.
În procesul de oxidare, se transformă într-un oxid mai înalt, unde arsenic demonstrează valoarea stării de oxidare +5.
Metalul pur este oxidat cu acid azotic diluat în acid clorhidric H3Aso3în care are o valență de 3. Conform capacităților sale chimice, se consideră acid cu rezistență moderată, similar cu acidul boric. Sărurile sunt arsenit, care prezintă proprietăți de reducere a luminii.
În clorură, metalul are o stare de oxidare de +3,acționând ca un element tipic de metal. Sucurile de arsen, care se formează prin interacțiunea cu metalele active, suferă hidroliză apoasă. De exemplu, arsina (AsH3) este un gaz otrăvitor, incolor, inodor.
Compuși organometalici
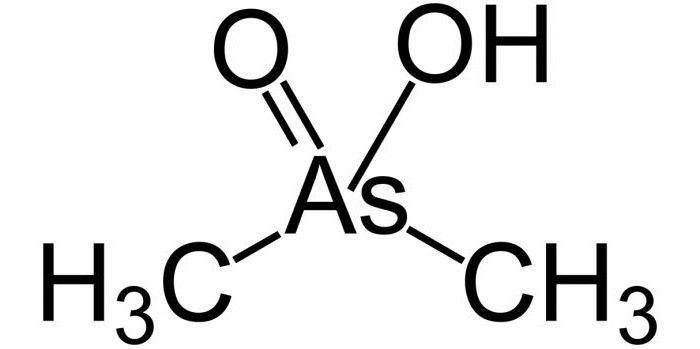
Arsenicul este capabil să formeze diverseCOMPUȘII ORGANOMETALICE. De exemplu, la sfârșitul secolului al XVIII-lea, când a fost distilat cu oxid de arsen (3) acetat de potasiu, a fost obținut un lichid cu miros neplăcut. Produsul rezultat a fost numit alarsină. În studiile ulterioare, sa constatat că arsenul este prezent.
La sfârșitul secolului al XIX-lea s-au sintetizatarsine aromatice. Reacția a fost efectuată prin expunerea la un amestec de triclorură de arsen și halogenură de arii cu sodiu metalic. Unele dintre aceste produse au prezentat proprietăți antimicrobiene. Astăzi, sintetizează zeci de mii de compuși organo-arsenici.
Utilizarea arsenicului
Mai mult de jumătate din metalul minatutilizat sub formă de diferiți compuși. În forma sa pură, practic nu este folosit. Într-o mică cantitate, acesta este introdus în aliajele de rulmenți. Astfel de aditivi au un efect pozitiv asupra durității produsului finit, astfel încât acestea sunt în cerere în fabricarea de cabluri electrice și baterii.
Dozele minime de creștere a arseniculuirezistența la coroziune, îmbunătățirea performanțelor termice ale alamelor și cuprului. Dacă acest element nu conține impurități suplimentare, în acest caz este necesar în fabricarea dispozitivelor semiconductoare. Pentru a le crea, arsenul este topit cu germaniu sau siliciu.
În plus, este o aliere excelentăaditiv la crearea oțelului. Ca duza valoroasă, arsenul este necesar și în metalurgia neferoasă. Chiar și datorită conținutului său scăzut în aliaj, este posibilă creșterea semnificativă a rezistenței produsului fabricat. Arsenic crește fluxul de cupru în timpul turnării, facilitând procesul de obținere a firului.
Există un anumit efect negativ al acestui metal de tranziție asupra producției. Prezența sa în minereu transformă procesul în producție dăunătoare.
Printre diversele compuși de arsenic de interesreprezintă oxidul său trivalent. Se utilizează în prezent la topirea sticlei. Sare cu un indicator de +5 sunt în cerere ca antiseptice. Acest element de tranziție este unul dintre cele mai populare în producția chimică modernă, deoarece prezintă proprietăți duale în funcție de mediul procesului.