Fier: structura atomului, schema și exemple. Structura electronică a atomului de fier
Luați în considerare structura electronică a atomului de fier, precum și localizarea acestuia în tabelul periodic. Descoperim proprietățile fizice și chimice de bază ale acestui element, domeniul de utilizare.
Poziția în PS
Fierul este elementul d al grupului 8 (un auxiliarsubgrupe). 26 are un număr de serie, masa atomică relativă - 56, în care atomul său conține 26 protoni, 26 electroni și 30 neutroni. Acest metal are o reactivitate ridicată, prezintă o reducere a proprietăților. stare tipică de oxidare +2, +3.
Caracteristici ale structurii atomului
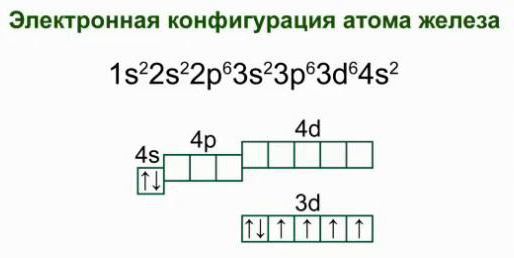
Care este schema electronică a structurii atomului de fier? Dacă luăm în considerare distribuția electronilor peste nivelele de energie, obținem următoarea variantă:
2e; 8e; 14 e; 2e. O astfel de structură a carcasei de electroni a atomului de fier indică locația sa în subgrup, confirmând apartenența la gena de elemente.

Fiind în natură
Fierul este unul dintre cele mai multecomună în natura elementelor chimice. În scoarța terestră, procentul său este de aproximativ 5,1%. Într-un număr mai mare în intestinul planetei noastre există doar trei elemente: siliciu, aluminiu, oxigen.
Minerele de fier se găsesc în diferite regiuni ale Pământului. Alchimiștii au găsit compuși ai acestui metal în soluri. În producția de fier este selectat minereul în care conținutul său depășește 30%.
Piatra magnetică magnetică conține aproximativ șaptezecidouă procente metalice. Principalele depozite de magnetit se află în anomalia magnetică Kursk, precum și în Uralul de Sud. În sânge, procentul de fier ajunge la 65%. Hematitul a fost descoperit în cartierul Krivoy Rog.

Importanța pentru plante și animale
Ce rol joacă fierul în organismele vii? Structura atomului explică proprietățile sale de reducere. Acest element chimic face parte din hemoglobină, conferindu-i o culoare roșie caracteristică. Aproximativ trei grame de fier pur, majoritatea din care este inclus în hemoglobină, se găsește în corpul unui adult. Scopul principal este de a transfera în țesuturile din plămâni oxigenul activ, precum și producția dioxidului de carbon format.
Acest metal și plantele sunt necesare. Fiind parte a citoplasmei, el participă activ la procesele de fotosinteză. Dacă planta nu are fier, frunzele sunt de culoare albă. Cu pansament minimal cu sare de fier, frunzele plantelor devin verzi.
Proprietăți fizice
Am luat în considerare structura atomului de fier. Circuitul confirmă prezența unui luciu metalic (există electroni de valență) în acest element. Metalul alb-argintiu are un punct de topire destul de ridicat (1539 grade Celsius). Datorită plasticității bune, acest metal este ușor supus laminării, ștanțării, forjării.
Abilitatea de magnetizare și demagnetizare, caracteristică fierului, a făcut din el un material excelent pentru producerea de miezuri de electromagneți puternici în diferite aparate și mașini electrice.
Cât de activ este fierul? Structura atomului arată prezența la nivel extern a doi electroni, care vor fi dați în timpul reacției chimice. Pentru a-și spori duritatea și rezistența, se efectuează o rulare suplimentară și o întărire a metalului. Astfel de procese nu sunt însoțite de o schimbare în structura atomului.

Soiuri de fier
Structura electronică a atomului de fier, a cărui schemăa fost considerată mai sus, explică caracteristicile sale chimice. Într-un metal tehnic pur, care este o oțel cu conținut redus de carbon, componenta principală este fierul. Ca impurități, s-au detectat circa 0,04 procente de carbon, fosfor, azot și sulf.
Fier fier din punct de vedere chimic prin exteriorparametrii este similar cu platina. A crescut rezistența la procesele de coroziune, este rezistent la acizi. La cea mai mică introducere a impurităților într-un metal pur, caracteristicile sale unice dispar.
Opțiuni pentru obținere
Structura atomilor de aluminiu și fier indicăcu privire la afilierea aluminiului amfoteric la subgrupul principal, posibilitatea utilizării acestuia în procesul de separare a fierului de oxizii săi. Aluminothermia, efectuată la temperaturi ridicate, face posibilă separarea metalelor pure de minereurile naturale. În plus față de aluminiu, hidrogen, monoxid de carbon (2), cărbunele sunt alese ca agenți reducători puternici.
Caracteristicile proprietăților chimice
Ce proprietati chimice are fierul? Structura atomului explică activitatea sa de restaurare. Pentru fier este caracteristic formarea a două rânduri de compuși având stări de oxidare de +2, +3.
În aerul umed, are loc procesul de ruginire(coroziune) a metalului, ducând la formarea hidroxidului feric (3). Cu oxigen, firul de fier încălzit reacționează cu aspectul unei pulberi neagră de oxid de fier (2,3), numită scară de fier.
La temperaturi ridicate, metalul este capabil să reacționeze cu vaporii de apă pentru a forma un oxid mixt. Procesul este însoțit de evoluția hidrogenului.
Reacția cu metale nu are loc decât atunci când componentele inițiale sunt preîncălzite.
Fierul poate fi dizolvat în acid sulfuric diluat sau acid clorhidric, fără preîncălzirea amestecului. Acidul sulfuric concentrat și acidul clorhidric pasivizează acest metal.
Ce alte proprietati chimice are fierul? Structura atomului acestui element indică activitatea sa medie. Această locație este confirmată de fier la hidrogen (H2) în seria electrochimică. În consecință, se poate deplasa din sărurile tuturor metalelor, care sunt situate la dreapta în rândul Beketova. Astfel, în reacția cu clorura de cupru (2), efectuată la încălzire, se izolează cuprul pur și se obține o soluție de clorură ferică (2).


Se folosește cea mai mare parte a fieruluiproducția de fontă și oțel. În fontă, procentul de carbon este de 3-4%, în oțel - nu mai mult de 1,4%. Acest non-metal îndeplinește funcția unui element care crește rezistența articulației. În plus, afectează în mod pozitiv proprietățile de coroziune ale aliajelor, crește rezistența materialului la o temperatură ridicată.
Adăugările de vanadiu sunt necesare pentru a îmbunătăți rezistența mecanică a oțelului. Cromul mărește rezistența la substanțe chimice agresive.
Proprietățile feromagnetice ale acestei substanțe chimiceelement a făcut-o în cerere în instalațiile industriale care includ electromagneți. În plus, fierul a găsit uzul său în industria suvenirurilor. Pe baza acesteia, sunt realizate diverse suveniruri, de exemplu, magneți colorați pe frigider.
Forța și ductilitatea permit utilizarea metalului pentru a crea armuri, diverse arme.
Clorura ferică (3) este utilizată pentru purificarea apei dinimpurități. În medicină, 26 elemente ale sistemului periodic al lui Mendeleev sunt utilizate în tratamentul unei boli cum ar fi anemia. În cazul lipsei de celule roșii din sânge există o oboseală rapidă, pielea dobândește o culoare palidă nenaturală. Pregătirile de fier ajută la eliminarea unei probleme similare, pentru a readuce corpul la o activitate deplină. O importanță deosebită are fierul pentru activitatea glandei tiroide, ficat. Pentru a evita probleme grave în corpul uman, este suficient să consumăm aproximativ 20 mg din acest metal pe zi.