Experiența lui Rutherford
Ernest Rutherford - unic, foarte talentatși un om de știință foarte neobișnuit. Trebuie remarcat faptul că cele mai importante descoperiri au fost făcute de el după ce a primit Premiul Nobel. În 1911, acest om a fost un succes experiențe de Rutherford (deci a fost numit mai târziu), ceea ce a permis să se uite în interiorul atomului și a obține o idee despre cum funcționează.
Au fost efectuate numeroase experimente cu atomiși mai devreme. Ideea lor principală era să adune o cantitate suficientă de informații din diferite unghiuri de abatere a particulelor, conform cărora ar exista o șansă de a spune ceva concret despre structura atomului. La începutul secolului XX, oamenii de știință erau deja convinși că conțineau electroni încărcați negativ. Cu toate acestea, cel mai răspândit la acel moment a fost ideea că atomul este similar cu o rețea subțire încărcată pozitiv, care este umplută cu electroni cu o sarcină negativă. Acest model a fost numit "grilă cu stafide".
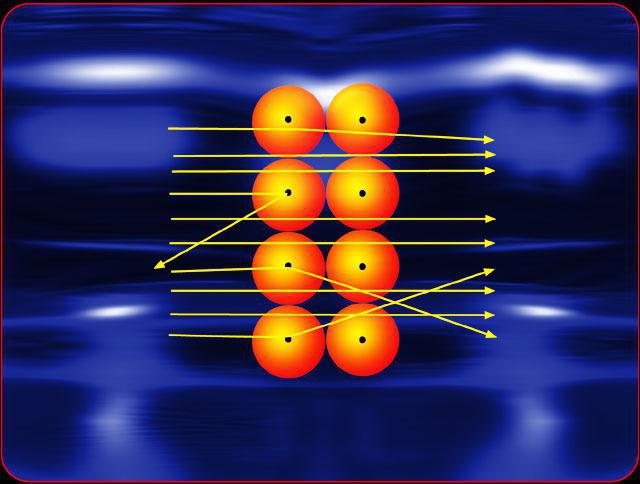
Experiența lui Rutherford a fost unică. Omul de știință a construit un tun, care a dat un flux concentrat și direcționat de particule. Arăta ca o cutie de plumb, în care era o fâșie îngustă. În interiorul acestuia a fost plasat material radioactiv. Particulele alfa, care sunt emise de o substanță radioactivă în toate domeniile cu excepția unuia, au fost absorbite de un ecran de plumb, și numai prin fanta zburat direcționată în mod specific cu fascicul de particule. Pe drum, apoi stabilește câteva ecrane de plumb cu sloturi care taie particulele se abat de la direcția corectă. Ca urmare a unor astfel de experiențe Rutherford a zburat până la fasciculul de particule țintă concentrat, ținta este în sine a reprezentat o folie metalică foarte subțire. În ea, și a lovit alfa-ray.
După ce particulele alfa s-au ciocnit cuatomii din folie, și-au continuat drumul și, în cele din urmă, s-au găsit pe ecranul luminescent instalat în spatele țintei. Atunci când particulele au lovit ecranul, s-au înregistrat flash-uri, conform cărora experimentatorul putea să judece cât și în ce măsură particulele alfa deviază de direcția directă a mișcării din cauza coliziunii cu atomii de folie de aur.
Experiența lui Rutherford a fost atât de originală,că nimeni nu a încercat să verifice dacă anumite particule se abat de la unghiuri mari. Modelul vechi al rețelei nu permite chiar existența unor elemente atât de grele și dense în atom care să poată respinge particule alfa foarte rapide la unghiuri suficient de mari.
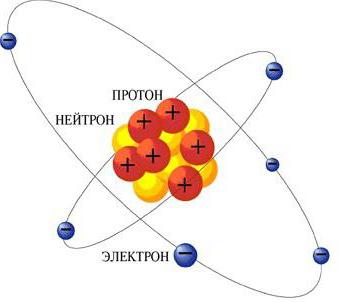
Experiența lui Rutherford a făcut posibil să se concluzioneze că o mareo parte din masă este concentrată într-o substanță foarte densă, care este situată chiar în centrul atomului. Restul era de fapt mult mai puțin dens decât părea înainte. Atomul lui Rutherford conținea un centru superdens, numit nucleul, în care, apropo, încărcătura pozitivă era concentrată.
Imaginea atomului, pe care omul de știință ni la atrasacum bine cunoscute. Modelul lui Rutherford constă în faptul că centrul este localizat în nucleu, cu o sarcină pozitivă, care este concentrată întreaga masă a atomului. În general, atomul este neutru. Prin urmare, numărul de electroni în interiorul aceleași ca și sarcina nucleului este egal cu numărul elementului în sistemul periodic. Este clar că electronii nu se pot odihni în interiorul atomului, deoarece ar cădea pur și simplu pe miez. Se mișcă în jurul ei în același fel în care planetele se rotesc în jurul luminării soarelui.
Acest tip de mișcare este determinat de acțiunile forțelorPandantivul de pe partea nucleului. Atomii sunt stabile în stare neexcitat, ei pot supraviețui pentru o perioadă lungă de timp, fără a emite nici unde electromagnetice. Dar modelul planetar al atomului, deși dovedit experimental, nu poate explica de ce este stabil.