Ecuația și măsurarea temperaturii de bază MKT
Studiul proceselor care apar în statisticieste complicată de dimensiunea minimă a particulelor și de un număr foarte mare de particule. Este practic imposibil să se ia în considerare fiecare particulă separat, prin urmare sunt introduse valori statistice: viteza medie a particulelor, concentrația lor, masa particulei. Formula care caracterizează starea sistemului cu toleranță la parametrii microscopici este numită ecuația de bază a teoriei moleculare-cinetice a gazelor (MKT).
Puțin despre viteza medie a particulelor
Determinarea vitezei de mișcare a particulelor a fost primaa fost efectuată experimental. Cunoscut din experiența programului școlar, condus de Otto Stern, a permis să creeze o idee despre vitezele particulelor. În cursul experimentului, a fost investigată mișcarea atomilor de argint în cilindrii rotativi: în primul rând, într-o stare staționară a instalației, atunci când sa rotit la o anumită viteză unghiulară.
Ca rezultat, sa constatat că viteza moleculelorargintul depășește viteza sunetului și este de 500 m / s. Faptul este destul de interesant, pentru că este dificil să se simtă astfel de viteze de mișcare a particulelor în substanțe.
Perfect gaz
Continuarea cercetării este posibilăDoar într-un sistem al cărui parametru poate fi determinat prin măsurători directe utilizând instrumente fizice. Viteza este măsurată cu un vitezometru, dar ideea de a atașa un vitezometru la o particulă individuală este absurdă. Se poate măsura direct numai parametrul macroscopic asociat cu mișcarea particulelor.
Orice sistem de corpuri de interacțiunecaracterizat de energia potențială și energia cinetică a mișcării. Gazul real este un sistem complex. Variabilitatea energiei potențiale nu poate fi sistematizată. Problema poate fi rezolvată prin introducerea unui model care poartă proprietățile caracteristice ale gazului, care atenuează complexitatea interacțiunii.
Gazul ideal este o stare de materie în careinteracțiunea dintre particule este neglijabilă, energia potențială a interacțiunii tinde la zero. Considerată importantă numai energia mișcării, care depinde de viteza particulelor.
Presiunea ideală a gazului
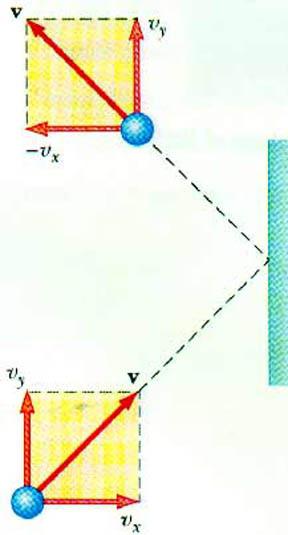
Identificați relația dintre presiunea gazului și vitezamișcarea particulelor sale permite ecuația de bază a MKT a unui gaz ideal. O particulă care se deplasează într-un vas, când se ciocnește cu un perete, îi transmite un impuls, magnitudinea căreia poate fi determinată pe baza celei de-a doua legi a lui Newton:
- FΔt = 2m0vx
Schimbarea momentului unei particule într-un impact elastic este asociată cu o schimbare a componentei orizontale a vitezei sale. F este forța care acționează pe partea laterală a particulei de pe perete pentru o perioadă scurtă de timp t; m0 Este masa particulei.
Cu o suprafață S, pentru un timp Δt toate particulele de gaz care se deplasează în direcția suprafeței cu viteza v se ciocnescx și situat într-un cilindru de volum SvxAt. La o concentrație a particulelor n exact jumătate din molecule se deplasează la perete, a doua jumătate - în direcția opusă.
După examinarea coliziunii tuturor particulelor, putem scrie legea lui Newton pentru forța care acționează asupra padului:
- FΔt = nm0vx2SΔt
Deoarece presiunea gazului este definită ca raportul dintre forța care acționează perpendicular pe suprafață și suprafața acesteia, putem scrie:
- p = F: S = nm0vx2
Relația rezultată ca ecuație MKT de bază nu poate descrie întregul sistem, deoarece este considerată numai mișcarea într-o singură direcție.
Distribuția Maxwell

Perturbări frecvente frecvente ale particulelor de gaze cupereți și unul cu celălalt conduc la stabilirea unei anumite distribuții statistice a particulelor în termeni de viteze (energii). Direcțiile tuturor vectorilor de viteză se dovedesc a fi la fel de probabile. Această distribuție a fost numită distribuția Maxwell. În 1860, acest model a fost dedus de Maxwell pe baza MKT. Parametrii principali ai legii distribuției sunt vitezele: probabile, corespunzătoare valorii maxime a curbei și rms vpătrat = √ <v2> Este pătratul mediu al vitezei particulelor.
O creștere a temperaturii gazului corespunde unei creșteri a valorii vitezelor.
Plecând de la faptul că toate vitezele sunt egale, iar modulele lor au aceeași valoare, putem presupune că:
- <v2> = <Vx2> + <Vy2> + <Vz2>, Din care: <vx2> = <V2>: 3
Ecuația de bază MKT care ia în considerare valoarea medie a presiunii gazului este:
- p = nm0<v2>: 3.
Această relație este unică prin faptul că determină relația dintre parametrii microscopici: viteza, masa particulelor, concentrația particulelor și presiunea gazului în ansamblu.
Folosind conceptul de energie cinetică a particulelor, ecuația de bază MKT poate fi rescrisă într-un mod diferit:
- p = 2nm0<v2>: 6 = 2n <Ela>: 3
Presiunea gazului este proporțională cu valoarea medie a energiei cinetice a particulelor sale.
temperatură
Este interesant faptul că pentru o cantitate neschimbată de gaze înUn vas închis poate fi asociat cu presiunea gazului și energia medie a energiei particulelor. Măsurarea presiunii poate fi făcută prin măsurarea energiei particulelor.
Ce ar trebui să fac? Ce valoare poate fi comparată cu energia cinetică? O astfel de valoare este temperatura.


Scară de temperatură universală
Mai interesant din punctul de vedere al independenței față deproprietățile fluidului de lucru pot fi considerate termometre cu gaz. Scala lor nu depinde de tipul de gaz utilizat. Într-un astfel de instrument, putem identifica ipotetic temperatura la care presiunea gazului tinde la zero. Calculele arată că această valoare corespunde la -273.15 despreS. Scara de temperatură (scala de temperatură absolută sau scara Kelvin) a fost introdusă în 1848. Punctul principal al acestei scări a fost luat ca o posibilă temperatură a presiunii gazului zero. Segmentul scalei unitare este egal cu valoarea unitară a scalei Celsius. Este mai convenabil să notăm ecuația MKT de bază utilizând temperatura, atunci când studiază procesele de gaze.
Relația de presiune și temperatură
Experimental, se poate verifica proporționalitatea presiunii gazului la temperatura sa. În același timp, sa constatat că presiunea este direct proporțională cu concentrația particulelor:
- P = nkT,
unde T este temperatura absolută, k este o valoare constantă egală cu 1,38 • 10-23J / K
Valoarea fundamentală, care are o valoare constantă pentru toate gazele, se numește constanta Boltzmann.
Comparând dependența de presiune asupra temperaturii și ecuația de bază a gazelor MKT, putem scrie:
- <Ela> = 3kT: 2
Valoarea medie a energiei cinetice a mișcării moleculelor de gaz este proporțională cu temperatura acesteia. Aceasta înseamnă că temperatura poate servi ca măsură a energiei cinetice a mișcării particulelor.







